Fragen und Antworten zur Mitteilung gefährlicher Produkte zur medizinischen Notfallversorgung in Deutschland für Mitteilungspflichtige nach Art. 45 der CLP-Verordnung
Grundlegende Überarbeitung der Version vom 23.12.2020. Die einzelnen Themenbereiche wurden neu gruppiert und mit Fragen aus der 14. BfR-Nutzerkonferenz zu Produktmitteilungen ergänzt.
Das Bundesinstitut für Risikobewertung (BfR) nimmt Produktmitteilungen der Industrie entgegen. Das BfR prüft diese Produktmitteilungen und stellt sie den Giftinformationszentren der Bundesländer zur medizinischen Notfallberatung zur Verfügung.
Hintergrund: Chemische Produkte sind meist komplex zusammengesetzte Gemische aus verschiedenen Inhaltsstoffen. Diese können aufgrund ihres Gefährdungspotentials – vor allem bei nicht bestimmungsgemäßem Gebrauch – Gesundheitsrisiken für Verbraucherinnen und Verbraucher verursachen. Personen und Unternehmen, die gefährliche (chemische) Gemische in Verkehr bringen, müssen dem BfR relevante Informationen mitteilen. Die gesetzliche Grundlage dafür ist Art. 45 der Verordnung über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen (EG) Nr. 1272/2008 (engl. CLP: classification, labelling and packaging), die über das Chemikaliengesetz (§ 16e ChemG) im nationalen Recht verankert ist.
Das BfR hat häufig gestellte Fragen zur Mitteilung von gefährlichen Produkten zusammengestellt, um diese sowie ausgewählte Detailfragen zum Thema Produktmitteilungen schnell und transparent zu beantworten. Ergänzende Informationen sind in den verlinkten Quellen zu finden.
SicherheitsdatenblattWelche Nummer kann ich als Notfallkontakt im Abschnitt 1.4 des Sicherheitsdatenblatts (SDB) angeben?
Sie können einen Notrufservice selbst organisieren oder eines der Giftinformationszentren (kostenpflichtig) damit beauftragen. Dementsprechend tragen Sie dann die Telefonnummer des eigenen Service oder die Telefonnummer des beauftragten Giftinformationszentrums in Abschnitt 1.4 des SDB ein. Die Angabe einer Telefonnummer des BfR oder der Feuerwehr ist nicht korrekt, da weder das BfR noch die Feuerwehr einen Notfallberatungsservice anbietet.
Gesetzliche Grundlage:
- Anhang II, Abschnitt 1.4, der REACH-Verordnung (EG) Nr. 1907/2006
Weitere Informationen:
Warum kann ich nicht das BfR als Notfallkontakt im Abschnitt 1.4 des Sicherheitsdatenblatts (SDB) angeben?
In der REACH-Verordnung heißt es: „Gibt es in dem Mitgliedstaat […] eine öffentliche Beratungsstelle […], so ist deren Telefonnummer zu nennen, was ausreichend sein kann.“
In Deutschland existiert – rechtlich gesehen – keine solche „öffentliche Beratungsstelle“. Auch das BfR ist keine „öffentliche Beratungsstelle“ und darf nicht als Notfallkontakt genannt werden. Des Weiteren leistet das BfR keine Notfallberatung und ist allein aus diesem Grund kein geeigneter Kontakt.
Gesetzliche Grundlage:
- Anhang II, Abschnitt 1.4, der REACH-Verordnung (EG) Nr. 1907/2006
Weitere Informationen:
Muss der Notfallkontakt im Abschnitt 1.4 des Sicherheitsdatenblatts (SDB) 24/7 erreichbar sein?
Nein, aber in diesem Fall müssen Sie im SDB die Servicezeiten angeben.
Gesetzliche Grundlage:
- Anhang II, Abschnitt 1.4, der REACH-Verordnung (EG) Nr. 1907/2006
Weitere Informationen:
Kann die gesundheitliche Notfallberatung auch auf Englisch erfolgen?
Die Inhalte des Sicherheitsdatenblattes müssen in der/den Amtssprache(n) des Mitgliedsstaates erstellt werden. Sinn und Zweck dieser Regelung ist, dass der Empfänger die Inhalte versteht und für eine sichere Verwendung des Stoffs oder Gemisches anwenden kann. Zur Sprache der Notfallinformationsdienste macht der Rechtstext keine gesonderte Aussage, aber nach oben benanntem Sinn und Zweck ist davon auszugehen, dass die Notfallberatung ebenfalls in der Amtssprache anzubieten ist. Das ist für Deutschland Deutsch.
Gesetzliche Grundlage:
- Art. 31, Abs. 5 der REACH-Verordnung (EG) Nr. 1907/2006
Weitere Informationen:
UFIWas ist ein UFI?
UFI steht für Unique Formula Identifier (eindeutiger Rezepturidentifikator) und ist ein eindeutiger 16-stelliger alphanumerischer Code, der über eine Produktmitteilung (Dossier) mit einer Rezeptur oder dem/den daraus konfektionierten Produkt/-en verknüpft wird. Er ist ein Pflichtbestandteil in der Mitteilung gefährlicher Gemische im PCN-Format.
Dem UFI-Code selbst (wo auch immer er verwendet wird) muss das Akronym "UFI:" in Großbuchstaben vorangestellt werden und muss deutlich sichtbar, lesbar und unauslöschlich gekennzeichnet sein. Das Akronym "UFI:" muss unabhängig vom Land, der Sprache und dem nationalen Alphabet immer in lateinischer Schrift verwendet werden, gefolgt von einem Doppelpunkt. Die Europäische Chemikalienagentur (ECHA) stellt mit dem UFI-Generator ein kostenfreies Werkzeug zu Erstellung eines oder mehrerer UFI zur Verfügung.
Wie erzeuge ich einen UFI?
Die Europäische Chemikalienagentur (ECHA) stellt mit dem UFI-Generator ein kostenfreies Werkzeug zu Erstellung eines oder mehrerer UFI zur Verfügung. Alternativ steht auch ein UFI-Generierungsalgorithmus für Unternehmen zur Verfügung. So kann der UFI-Generator in die eigenen Systeme integriert werden.
Weitere Informationen:
Kann ich verschiedene UFIs für ein Gemisch verwenden, dass mit verschiedenen Handelsnamen und möglicherweise von verschiedenen Unternehmen auf den Markt gebracht wird?
Ja, ein Unternehmen kann mehrere UFIs für dasselbe Gemisch generieren, die unter demselben oder verschiedenen Handelsnamen auf den Markt gebracht werden. Es kann auch der gleiche UFI von verschiedenen Unternehmen entlang der Lieferkette verwendet werden, solange die Zusammensetzung gleichbleibt. Es kann also einen oder mehrere UFIs für dieselbe Rezeptur geben.
Ein Unternehmen kann so zum Beispiel getrennt nach Marktgebiet, Sprache oder Handelsname unterschiedliche UFIs zuordnen.
Wie übermittle ich einen UFI an das BfR?
Der UFI ist Bestandteil einer Produktmitteilung im PCN-Format. Sie können bei der Erstellung einer PCN-Mitteilung entweder einen UFI für alle Produkte einer Rezeptur vergeben oder jedem Produkt einen eigenen UFI zuordnen.
Wann muss ich in meiner Produktmitteilung (PCN) einen neuen UFI für mein Produktgemisch angeben?
Bei der Erstmitteilung eines gefährlich eingestuften Produkts und nach signifikanter Rezepturänderungen eines Produkts muss ein neuer UFI vergeben und in einer Produktmitteilung übermittelt werden. In beiden Fällen wird auch eine neue PCN-Nummer (nicht die submission number) vergeben. Bei Produktmitteilungen mit signifikanter Rezepturänderung muss in dem Dossier die PCN-Nummer der vorherigen Produktversion als related PCN-Nummer angegeben werden.
Weitere Informationen:
Verpflichtung zur Mitteilung im PCN-Format und ÜbergangsfristenWas muss gemeldet werden und was nicht?
Alle Gemische, die als gesundheitlich und physikalisch gefährlich eingestuft sind, sind mitteilungspflichtig.
Nicht mitteilungspflichtig sind:
- nur umweltgefährliche Gemische
- Gase unter Druck
- explosive Gemische
- Gemische für wissenschaftliche Forschung und Entwicklung
- Gemische für prozessorientierte Forschung und Entwicklung
Ab wann bin ich verpflichtet, eine Produktmitteilung im PCN-Format zu erstellen?
Die CLP-Verordnung unterscheidet nach Produktgemischen für private/gewerbliche und für ausschließlich industrielle Verwendung. Seit dem 01.01.2024 müssen alle Produktmitteilungen, also Erstmitteilungen und Updates, im PCN-Format, einem speziellen Format für die Meldung an Giftnotrufzentralen, erfolgen (PCN: Poison Centers Notification). Es gelten folgende Übergangsregelungen:
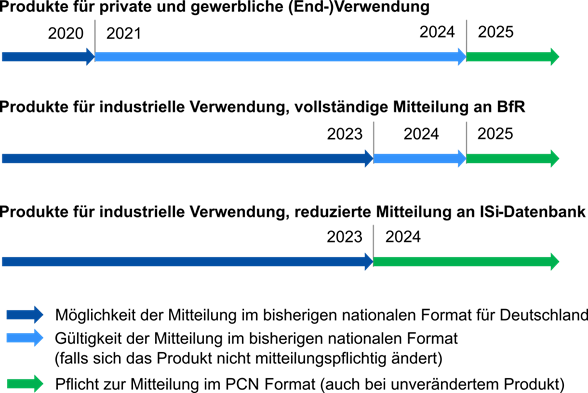
Welche Mitteilungswege für als gefährlich eingestufte Produkte gibt es für Deutschland?
Deutschland akzeptiert Produktmitteilungen für als gefährlich eingestufte Produkte/Gemische ausschließlich im PCN-Format (i6z-Datei). Die Europäische Chemikalienagentur (ECHA) bezeichnet eine Produktmitteilung als Dossier. Für die Übermittlung eines Dossiers existieren zwei Mitteilungswege:
- Die Mitteilung über das Submission Portal der ECHA. Hierbei verteilt die ECHA das Dossier an die im Dossier zur Vermarktung angegebenen Mitgliedsstaaten. Für Deutschland erhält das BfR die Mitteilungen. Nach der Übertragung des Dossiers an das ECHA-Portal erhalten Sie einen Link auf eine dossierspezifische Submission Status Page, die unter Submission Events Informationen über den Status und den Erfolg Ihrer Mitteilung erhält. Sobald Ihre Mitteilung beim BfR eingegangen ist, ist die Mitteilungsverpflichtung formal erfüllt (Submission Event: Dossier received by DE) und es erfolgt keine weitere Bestätigung durch das BfR.
- Für Produktmitteilungen, die ausschließlich Produkte für den deutschen Markt enthalten, besteht die Möglichkeit, die i6z-Datei direkt über das BfR-Portal zu übermitteln.
Für direkt an das BfR übermittelten Produktmitteilungen erstellt das BfR Bestätigungsschreiben, die die formale Akzeptanz bescheinigen und an den Mitteilenden übersandt werden.
Kann das BfR nach der formalen Akzeptanz einer Produktmitteilung noch Korrekturen einfordern?
Ja, das BfR unterzieht alle Produktmitteilungen einer inhaltlichen Validierung und fordert ggf. Informationen nach oder Korrekturen, die es für die Erledigung seiner Aufgaben als notwendig erachtet.
Gesetzliche Grundlage:
- Art. 45, Abs. 3 der CLP-Verordnung (EG) Nr. 1272/2008
Wann ist ein Lohnhersteller bzw. Rebrander/Relabeller in der Mitteilungspflicht?
Ein Lohnhersteller ist immer mitteilungspflichtig nach Art. 45 CLP-Verordnung, er ist der verantwortliche Inverkehrbringer (Submitter). Ein nachfolgender Relabeller/Rebrander als nachgeschalteter Anwender(1) ist nur dann ebenfalls mitteilungspflichtig, wenn er eine der folgenden Tätigkeiten ausführt:
- Umetikettieren
- Umfüllen
- Änderung der Umverpackung
Ist der Relabeller/Rebrander nicht mitteilungspflichtig, weil er das Produkt so beauftragt wie es in den Handel kommt, entsteht die Situation, dass im PCN-Dossier der Lohnhersteller als Submitter angegeben ist, wohingegen auf dem Etikett des Produkts der Relabeller/Rebrander steht. Das ist korrekt und bedeutet, dass die Firma auf dem Etikett nicht immer die mitteilungspflichtige Firma ist. Zur Identifizierung – z. B. im Vergiftungsfall – kann somit der Firmenname nicht herangezogen werden. Entscheidend ist dafür der Produktname in Kombination mit dem UFI-Code (Unique Formula Identifier, s. Abschnitt UFI).
(1) Einige Länder, auch Deutschland, sind der Rechtsauffassung, dass Relabeller/Rebrander zum so genannten Nachgeschalteten Anwender werden und somit mitteilungspflichtig nach Art 45 CLP-Verordnung sind.
RezepturKann ich Parfümstoffe zu einem Eintrag in der Rezeptur zusammenfassen?
Produktgemische, die sich lediglich in der Zusammensetzung ihrer Parfümstoffe unterscheiden, können in einer Gruppenmitteilung mit Generischem Bestandteilidentifikator (engl. Generic Component identifier, GCI) in einer Mitteilung zusammengefasst werden, die unter folgenden Bedingungen erfolgen darf:
- Alle Produktgemische in der Gruppe beinhalten mit Ausnahme der Parfümstoffe dieselbe qualitative Zusammensetzung (Stoffe und Konzentrationen).
- Für jede Komponente ist die gemeldete Konzentration oder der Konzentrationsbereich gleich.
- Alle Gemische in der Gruppe haben dieselbe Einstufung bezüglich gesundheitlicher und physikalischer Gefahren (Unterschiede in der Einordnung hinsichtlich von Umweltgefahren sind erlaubt).
- Die Gesamtkonzentration der Parfümstoffe überschreitet nicht 5 %.
Weitere Informationen:
Wie gebe ich eine Produktrezeptur an, wenn mein Lieferant mir nicht die vollständige Rezepturinformation mitteilt?
Prinzipiell besteht die Möglichkeit, anstatt eines Stoffes ein Gemisch als Rezeptur-bestandteil anzugeben (ein so genanntes Gemisch im Gemisch, engl.: mixture in mixture, MiM), sofern dem Mitteilenden die vollständige Rezeptur eines eingemischten Gemisches nicht vorliegt. Grundsätzlich sollen alle Informationen zur Rezeptur, die verfügbar sind, mitgeteilt werden. Daraus ergeben sich folgende Informationen, die in einer MiM-Angabe enthalten sein müssen:
Falls das MiM dem BfR in einer früheren PCN-Mitteilung mitgeteilt wurde:
- Produktidentifikator (Handelsname oder Bezeichnung des MiM)
- UFI
- Konzentration
- Einstufung in Bezug auf gesundheitliche und physikalische Auswirkungen
Falls ein UFI für das MiM vorliegt, aber das BfR die Informationen über das MiM nicht in einer vorherigen PCN-Mitteilung erhalten hat:
- Produktidentifikator (Handelsname oder Bezeichnung des MiM)
- UFI
- Konzentration
- Einstufung in Bezug auf gesundheitliche und physikalische Auswirkungen
- Name, E-Mail-Adresse und Telefonnummer des MiM-Lieferanten
- die im Sicherheitsdatenblatt des MiM enthaltenen Informationen zur Zusammensetzung
- alle anderen bekannten Bestandteile des MiM
Falls kein UFI für das MiM vorliegt:
- Produktidentifikator (Handelsname oder Bezeichnung des MiM)
- Konzentration
- Einstufung in Bezug auf gesundheitliche und physikalische Auswirkungen
- Name, E-Mail-Adresse und Telefonnummer des MiM-Lieferanten
- die im Sicherheitsdatenblatt des MiM enthaltenen Informationen zur Zusammensetzung
- alle anderen bekannten Bestandteile des MiM
Weitere Informationen:
- CLP-Verordnung, Art. 18, Abs. 3a (Produktidentifikatoren)
- CLP-Verordnung, Anhang VIII, Teil B, Abschnitt 3.2.2 (Gemisch im Gemisch)
Mitteilungsverfahren und KostenWieviel kostet eine Produktmitteilung für Deutschland?
Alle Produktmitteilungen an das BfR sind kostenfrei.
Kann ich dem BfR direkt eine Produktmitteilung senden oder muss das über die ECHA erfolgen?
Produktmitteilungen im PCN-Format werden entsprechend ihrer Angabe der Märkte von der ECHA auf die Staaten verteilt.
Deutschland erlaubt jedoch auch die direkte Übermittlung einer Produktmitteilung (als i6z-Datei) an das BfR, wenn die Produktmitteilung ausschließlich Produkte für den deutschen Markt enthält.
Erhalte ich eine Bestätigung vom BfR über den Erhalt der Produktmitteilung?
Nach Abschluss der Mitteilung über das ECHA-Portal erhalten Sie einen Link auf eine mitteilungsspezifische Submission Status Page. Informationen über den Status und den Erfolg Ihrer Mitteilung erhalten Sie dort unter Submission Events. Das Submission Event Dossier received by DE ist die formale Bestätigung Ihrer Produktmitteilung.
Falls Sie ein kommerzielles Softwareprodukt mit System-2-System (S2S) Übermittlung Ihrer Produktmitteilungen an die ECHA verwenden, sollte es eine vergleichbare Rückmeldung in Ihrer Software geben. Ziehen Sie ggf. das Handbuch zu Rate oder setzen Sie sich mit dem Hersteller Ihres Softwareprodukts in Verbindung.
Falls Sie eine Produktmitteilung im PCN-Format in Form einer i6z-Datei direkt an das BfR gesendet haben, erhalten Sie nach Prüfung ein Bestätigungsschreiben per Post. Informieren Sie sich über die Bedingungen, wann der direkte Weg an das BfR zulässig ist in der Antwort auf die Frage „Kann ich dem BfR direkt eine Produktmitteilung senden oder muss das über die ECHA erfolgen?“ dieser FAQ.
Weitere Informationen:
Wie erfolgt die Produktmitteilung als „Foreign User“ am ECHA-Submission-Portal?
Jede zur Mitteilung verpflichtete Firma („Submitter“) muss einen eigenen Account beim ECHA-Submission-Portal anlegen, um die Mitteilung in ihrem Namen durchführen zu können.
Soll die Mitteilung von einem Dritten, dem so genannten „Foreign User“, im Auftrag einer anderen mitteilungsverpflichteten Firma durchgeführt werden, muss die Firma den Dritten als „Foreign User“ dazu bemächtigen, auf deren Account zugreifen zu können, um die Mitteilung durchzuführen.
Der Dritte muss dafür ebenfalls einen Account bei der ECHA einrichten und meldet sich zunächst mit dem eigenen Account an, wechselt dann zum Account der Firma und führt in deren Namen die Mitteilung durch. Im Dossier erscheint dann ausschließlich die mitteilungsverpflichtete Firma.
Weitere Informationen:
- PCN: Eine Praxisanleitung (beschreibt u.a. die Einrichtung eines „Foreign Users“)
Wie halte ich bei einer Produktmitteilung als „Foreign User“ (Lohnhersteller) die Rezeptur gegenüber der mitteilungsverpflichteten Firma (Relabeller) geheim?
Dafür benötigen beide Firmen einen ECHA-Account, und der Lohnhersteller muss vom Relabeller als „Foreign User“ eingerichtet sein. Der Lohnhersteller übermittelt mit seinem eigenen Account eine Produktmitteilung mit den Rezepturangaben und UFI (falls vorhanden). Der Lohnhersteller wechselt auf den Account des Relabellers („Switch legal entity“) und übermittelt die Produktmitteilung für den Relabeller als 100% MiM des von ihm zuvor übermittelten Produkts.
Weitere Informationen:
Wo erhalte ich Informationen darüber, wie andere am PCN-Verfahren teilnehmende Staaten Produktmitteilungen handhaben?
Informationen über alternative Mitteilungswege, erlaubte Sprachen, Gebühren und früheste Markplatzierung finden sie im Dokument Overview of Member States decisions on implementing Annex VIII to the CLP auf der Webseite der ECHA.
Auf dieser Seite sind ebenfalls die Benannten Stellen (Appointed Bodies) der teilnehmenden Staaten inklusive derer Kontaktdaten zu finden.
Weitere Informationen:
Wie übermittle ich ein eine freiwillige Produktmitteilung im XProduktmeldung-Format?
Für freiwillige Produktmitteilungen nicht mitteilungspflichtiger Produkte akzeptiert das BfR auch die Übermittlung über das nationale Verfahren im XProduktmeldung-Format.
Sie finden die benötigten Formulare auf der BfR-Website unter Mitteilung von Produkten in der rechten Spalte.
1.) Mit dem ersten Formular beantragen Sie einmalig einen Firmencode. Dazu füllen Sie das Formular aus und senden es an produkt-meldungen@bfr.bund.de. Sie erhalten dann in Kürze Ihren Firmencode. Sollten Sie für Ihre Firma bereits einen Firmencode erhalten haben, können Sie diesen für die XProduktmeldung verwenden.
2.) Die zweite Datei im zip-Format enthält unter anderem die Dateien XProduktmeldung_BfR.xls (32-bit Version) bzw. XProduktmeldung_BfR_64_Bit.xlsm (64-bit Version). Mit einer dieser Dateien erfassen Sie die Daten Ihres Produkts. Dabei tragen Sie als Firmenangabe immer den Firmencode ein. Anschließend erzeugen Sie die XML-Mitteilung durch Drücken des Buttons und speichern sie lokal ab. Dabei erscheint ein Popup, in das Sie wieder den Firmencode eintragen.
3.) Anschließend übermitteln Sie die XML-Datei über das BfR-Portal. Voraussetzung für die Nutzung des BfR-Portals ist ein Nutzerkonto (Account), das Sie sich vor dem erstmaligen Hochladen erzeugen. Dieser Account ist unabhängig vom BfR-Firmencode und gewährleistet eine sichere Datenübertragung.
Ist die Mitteilung an das BfR erfolgreich verlaufen, erhalten Sie innerhalb von zwei bis vier Wochen nach Eingang ein Bestätigungsschreiben.
Hinweise:
- Entgegen dem PCN-Format, wo Sie eine Rezeptur übermitteln und dieser Rezeptur mehrere Produkte zuordnen, übermitteln Sie im XProduktmeldung-Format einzelne Produkte mit ihrer Rezeptur.
- Auch wenn der eindeutige Rezepturidentifikator (Unique Formula Identifier, UFI) nicht Bestandteil des XProduktmeldung-Formats ist, können sie Ihren Produkten trotzdem einen UFI zuweisen. Tragen Sie dazu den UFI im Feld Sonstige Produktidentifikation des Tabellenblatts Meldung Teil 4 des Excel-Formulars in der Form „UFI: xxxx-xxxx-xxxx-xxxx“ (ohne Anführungszeichen) ein. Das BfR empfiehlt die optionale UFI-Angabe, da sie eine schnelle und sichere Rezepturzuordnung in der Giftnotrufberatung erleichtert.
- Sie können ausschließlich Produkte für den deutschen Markt im XProduktmeldung-Format übermitteln.
- Es stehen vergleichbare Formulare für Openoffice zur Verfügung.
Wie erzeuge ich einen UFI?
Die Europäische Chemikalienagentur (ECHA) stellt mit dem UFI-Generator ein kostenfreies Werkzeug zu Erstellung eines oder mehrerer UFI zur Verfügung. Alternativ steht auch ein UFI-Generierungsalgorithmus für Unternehmen zur Verfügung. So kann der UFI-Generator in die eigenen Systeme integriert werden.
Weitere Informationen:
Kombination eines Gemisches mit anderen Gemischen oder ProduktenWie übermittle ich ein Produkt, das mehrere Gemische enthält, die getrennt voneinander vorliegen? (z. B. Geschirrspül-Tabs/-Pods, Zweikomponentenkleber)
Jedes nach CLP-VO als gesundheitlich oder physikalisch gefährlich eingestufte Gemisch muss in einer eigenen Mitteilung mit einem eigenen UFI mitgeteilt werden.
Vergeben Sie in den Produktmitteilungen für die einzelnen Gemische die gleiche Mehrkomponenten-ID, um die Zugehörigkeit zu einem Gesamtprodukt zu kennzeichnen.
Informationen über die im Gebrauch des Produkts entstehende Mischung sind auch für die medizinische Notfallversorgung interessant und sollten ggf. im Abschnitt zur Toxikologie des Sicherheitsdatenblattes angegeben werden.
Weitere Informationen:
- Leitlinie zu harmonisierten Informationen für die gesundheitliche Notversorgung – Anhang VIII der CLP-Verordnung, Abschnitt 4.2.8.1 (Mehrkomponentenprodukte)
- Leitlinien zur Kennzeichnung und Verpackung gemäß Verordnung (EG) Nr. 1272/2008, Abschnitt 6.2 (Specific case: labelling of two-component products)
Wie übermittle ich ein Produktgemisch, das in einem anderen Produkt, das kein Gemisch ist, integriert ist? (z. B. Stempelkissen, Kerzen, Feuchtwischtücher)
Bei dem anderen Produkt handelt es sich um ein sogenanntes Erzeugnis. Die Leitlinie unterscheidet verschiedene Fälle. Bitte informieren Sie sich in dem entsprechenden Abschnitt der Leitlinie (siehe weitere Informationen), da die Inhalte zu umfangreich sind, um sie hier geeignet zusammenzufassen.
Weitere Informationen:
- Leitlinie zu harmonisierten Informationen für die gesundheitliche Notversorgung – Anhang VIII der CLP-Verordnung, Abschnitt 3.1.1.4 (Einfuhr/Herstellung einer Kombination aus Gemisch und Erzeugnis)
Freiwillige Produktmitteilung von ungefährlichen ProduktenWie übermittle ich ein eine freiwillige Produktmitteilung im PCN-Format?
Im PCN-Format besteht auch die Möglichkeit, nicht mitteilungspflichtige oder Produkte, die nur aus einem Stoff bestehen, zu übermitteln. Kennzeichnen Sie dazu Ihre PCN-Mitteilung unter Submission Type als Voluntary Submission (freiwillige Mitteilung).
Weitere Informationen:
